Stress wird mittlerweile im Zusammenhang mit vielen Erkrankungen angesehen. Kürzlich schrieb ich einen Artikel in dem ich erklärte, wie Stress uns auf die Verdauung schlägt und bei der Entstehung von Reizdarm und intestinaler Permeabilität (Leaky Gut) beteiligt ist. Wie ich vielfach auf meinem Blog verdeutliche, hängen der Darm, die Haut und das Gehirn (und damit die Psyche) stark voneinander ab. Eine Bedrohung wird immer zunächst im Gehirn registriert, was dann eine Kaskade von Reaktionen über das Hormon-, das Nerven- und das Immunsystem in Gang setzt, die Auswirkungen auf alle Organe nehmen.
Stress nimmt auch einen direkten Einfluss auf die Hautbarrierefunktion. Erschütternde Ereignisse wie der Tod eines Angehörigen oder familiäre Probleme können zum Ausbruch oder Verschlimmerung von Neurodermitis führen, aber ebenso der unterschwellige Alltags- und Berufsstress. Stress verschlimmert nachgewiesenermaßen auch andere Erkrankungen wie Asthma und Autoimmunerkrankungen wie Psoriasis und Multiple Sklerose durch eine negative Beeinflussung des Immunsystems. Es konnte eine Erhöhung im Blut vom IgE-Level und Eosinophilen bei im Labor getestetem Stress festgestellt werden, sowie ein Anstieg bestimmter Cytokine (Entzündungsmarker).
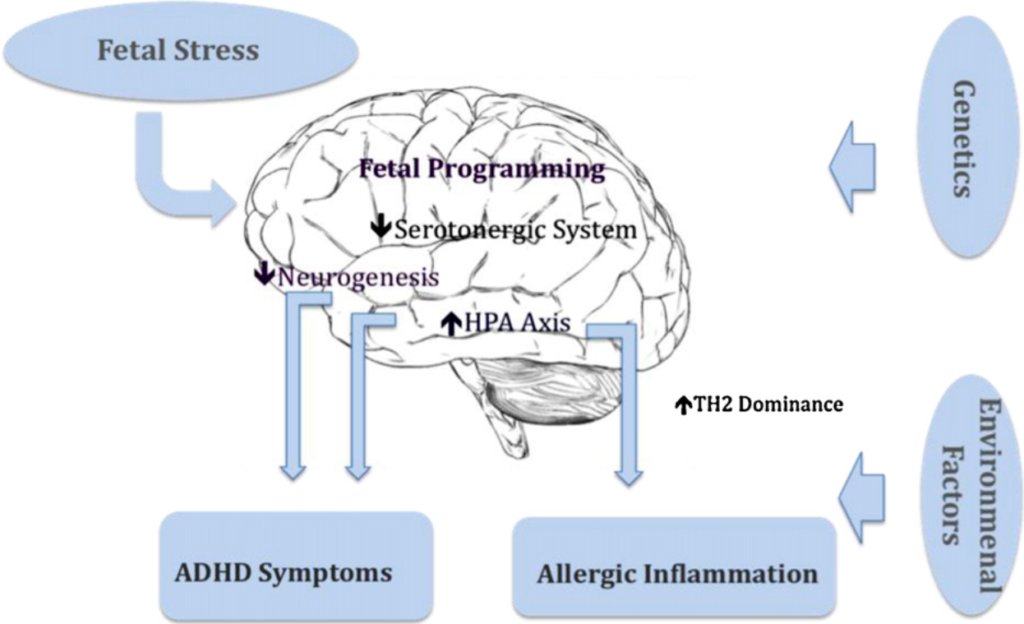
Dieser Sachverhalt ist nicht nur während unseres Lebens wichtig! Neuere Studien konnten einen Zusammenhang zwischen Stress der Mutter während der Schwangerschaft, einem erhöhten IgE-Wert im Nabelschnurblut und einem erhöhten Risiko für die Entwicklung von atopischen Erkrankungen bei Kindern zeigen. Starker, perinataler Stress der Mutter durch stressige Phasen oder traumatische Ereignisse, zum Beispiel durch den Tod eines Angehörigen, Scheidung, Verlust der Arbeitsstelle (selbst oder Partner), Umzug, Eheprobleme, Diskriminierung, Depression, Geldsorgen, Naturkatastrophen, Krieg oder sexuellen Missbrauch wurden in Zusammenhang mit einem erhöhten Risiko für ASD (Autismus Spektrum Störung, autism spectrum disorder), Schizophrenie, Depression oder ADHS (Aufmerksamkeits-Defizit-Hyperaktivitäts-Störung) beim Nachkommen gebracht. Der Anteil an Frauen, die ihre Ehe während der Zeit der Schwangerschaft als erfüllt beschreiben, ist geringer unter Müttern mit ADHS-betroffenen Kindern. Der Effekt blieb statistisch signifikant, selbst wenn stressbedingte, sekundäre Einflüsse wie Rauchen herausgerechnet wurden.
Eine weitere Studie zeigte hingegen, dass ein starkes soziales Netzwerk und gute Unterstützung der werdenden Mutter das Risiko von Geburtskomplikationen trotz schlimmer, einschneidender Erlebnisse erheblich verringern konnte.
Auch hierfür gibt es wieder psychoneuroimmunologische und psychoneuroendokrinologische Erklärungen. Wie man heute weiß, sind Immunkomponenten wie Cytokine und Kortisol in der Lage, die Plazentaschranke zu durchdringen und Einfluss auf das ungeborene Kind zu nehmen, z.B. auf Darm und Gehirn. Gegen Ende der Schwangerschaft wird die Plazenta durchlässiger, hier besteht die größte Gefahr für einen negativen Einfluss. Die Aktivierung des sympathischen Nervensystems durch Stress sorgt darüber hinaus für eine geringere Versorgung der zentralen Organe mit Blut, was eine Unterversorgung der Gebärmutter und des Fötus mit Sauerstoff und Nährstoffen zur Folge hat.
Gezielte Versuche mit trächtigen Affen und Mäusen bestätigten diese Funde und zeigten, dass es keiner lebensbedrohlichen Situationen bedarf oder körperlicher Verletzung. Unerwartete, laute Geräusche wie eine Sirene oder das einmalige Spritzen von Stresshormonen genügten bereits, um bei den Nachkommen zu einer erhöhten Angstneigung und kürzeren Aufmerksamkeitsspanne zu führen. Je nach Zeitpunkt in der Schwangerschaft, in dem die Störung auftrat, kann es zu Auffälligkeiten in unterschiedlichen Bereichen kommen, je nachdem, welcher Entwicklungsprozess beim Embryo gerade im Gange ist (motorisch, kognitiv, Kommunikation…).
Der Effekt von Stress ist so hoch, dass manche Forscher ihn als teratogen (fruchtschädigend) bezeichnen.
Eine weitere Studie an Kindern zeigte ein erhöhtes Risiko für die Entwicklung von ASD, wenn es in den ersten 6 Lebensmonaten zu einem negativen Vorkommnis in der Familie kam, wie der Tod eines Angehörigen.
Stress kann man dementsprechend als einen Umweltfaktor bezeichnen, der epigenetische Veränderungen hervorrufen kann, sodass es zu einer veränderten Signalgebung auf zellulärer Ebene kommt.
Das Immunsystem spielt bei der neuronalen Plastizität, beim Lernen und Verinnerlichen von Erlebten eine große Rolle. Bei stressinduzierten Erlebnissen, die man sich merkt, also bei negativen oder traumatischen Erfahrungen, spielt zudem das Hormonsystem mit hinein, nämlich über die HPA-Achse (Hypothalamus-Hypophysen-Nebennierenrinden-Achse, „Stressachse“). Das Zusammenwirken von Glucocortikoiden (Kortisol), Neurotransmittern und Cytokinen stärkt neue synaptische Verbindungen, die Vermeidungs- und Angstverhalten begünstigen. Es gibt allerdings Ausnahmen der Regel, sodass es bei zu schwerem Trauma durch eine Überproduktion dieser Moleküle zu Amnesie kommen kann.
Im Grunde wird der Mensch, entweder während seines Lebens oder sogar schon während seiner Entwicklung im Mutterleib, auf eine gefährliche Umwelt „programmiert“. Der Hirnbereich, der für das Wahrnehmen von Gefahren und Angstempfinden zuständig ist, das limbische System, wird übermäßig ausgebildet, zu Lasten anderer Bereiche, die für höhere kognitive Leistungen zuständig sind. Desweiteren kommt es zu Störungen im Dopaminhaushalt, was Sinn macht, da in einer feindlichen Umwelt ein Übermaß an Motivation und Neugier tödlich enden könnte.
Eine Störung in der HPA-Achse, z.B. durch Nebennierenerschöpfung (adrenal fatigue) kann dagegen zu schlechterer Gedächtnisleistung führen. Auch hier zeigt sich: Unsere Organsysteme sind miteinander verbunden und in ständiger Interaktion, und auch das Gehirn ist weniger isoliert, als bislang angenommen.
Bei ASD-Betroffenen sind oftmals hohe Stresslevel, Schwierigkeiten im Umgang mit neuartigen und unerwarteten Situationen, daraus resultierende Aggressionen und Angststörungen zu verzeichnen, was auch anhand eines erhöhten Kortisolspiegels nachgewiesen werden kann. In einer Vergleichsstudie an erwachsenen Autisten wurde ein 3 mal höherer Angstlevel als bei Kontrollprobanden festgestellt. Bei Angstzuständen sieht man vermehrt stereotype Verhaltensweisen bei autistischen Kindern. Dasselbe konnte bei jungen, frisch entwöhnten Affen beobachtet werden.
Dahingegen konnte bei einer Studie mit Kindern, die eine verzögerte kognitive Entwicklung zeigten, ein deutlicher Anstieg des IQ Levels und höhere Stresstoleranz erreicht werden, indem den Eltern aufgetragen wurde, 12 Minuten pro Tag systematisch Lob und positive Bestätigung zur Stärkung des Kindes einzusetzen. Das erstaunlichste ist, dass mehr als die Hälfte dieser Kinder bei einem Test nach anderthalb Jahren nun gleiche oder ÜBERdurchschnittliche kognitive Ergebnisse erzielten im Vergleich zu anderen Kindern ihres Alters.
Immunzellen besitzen Rezeptoren für Hormone, Neuropeptide und die Monoamine Serotonin und Dopamin, sie werden also durch sie beeinflusst. Bei ASD- und Neurodermitis-Betroffenen lassen sich erhöhte Serumwerte an den Stresshormonen Substanz P (SP), Neurotensin (NT) und Corticotropin-Releasing Hormone (CRH) im Vergleich zu nicht-betroffenen, gleichaltrigen Kindern messen.
NT sorgt für die Entwicklung von mehr CRH-Rezeptoren, was noch empfindlicher gegen Stress macht. Es sorgt außerdem im Gehirn für Proliferation von Mikroglia, was eine chronische, unterschwellige Hirnentzündung begünstigt, und stimuliert Glutamatrezeptoren, was mit neuronaler Schädigung im Zusammenhang steht. CRH aktiviert die HPA-Achse und sorgt für die Ausschüttung von Glucocorticoiden (Kortisol) und Katecholaminen (Adrenalin). NT kann direkt neurotoxisch und CRH direkt neuroinflammatorisch wirken. Stress kann Mastzellen im Gehirn durch CRH aktivieren, woraufhin sie Entzündungs- und gefäßerweiternde Botenstoffe wie Histamin ausschütten, was zu einer erhöhten Blut-Hirn-Schranken Durchlässigkeit führt. CRH arbeitet darüber hinaus synergistisch mit NT zusammen und sorgt nochmals für eine verstärkte Gefäßdurchlässigkeit. Immunzellen und Toxine können nun aus dem Körper ins Gehirn eindringen, und ebenfalls für Entzündungsvorgänge sorgen.
SP, NT und CRH kommen nicht nur im Gehirn vor, sondern werden auch im Darm und in der Haut von Nerven sekretiert. Mastzellen finden sich hier um Nervenendigungen angeordnet. Im Darm sorgen die Stresshormone durch Mastzellaktivierung für intestinale Permeabilität (durchlässiger Darm, leaky gut) und damit ebenfalls für ein höheres Entzündungslevel. In der Haut sind sie an der Entstehung von Entzündungen und Ekzemen beteiligt und besitzen hier ebenfalls gefäßerweiternde Eigenschaften, indem sie für Mastzellaktivierung und damit Ausschüttung von Histamin und anderen Entzündungsstoffen sorgt, was zu einer starken Störung der Hautbarriere führt. Bei Dauerbelastung entstehen Hautkrankheiten wie Kontaktallergien, Akne, Psoriasis und atopisches Ekzem. Man spricht inzwischen sogar davon, dass die Haut ihr eigenes Äquivalent zur HPA-Achse besitzt.
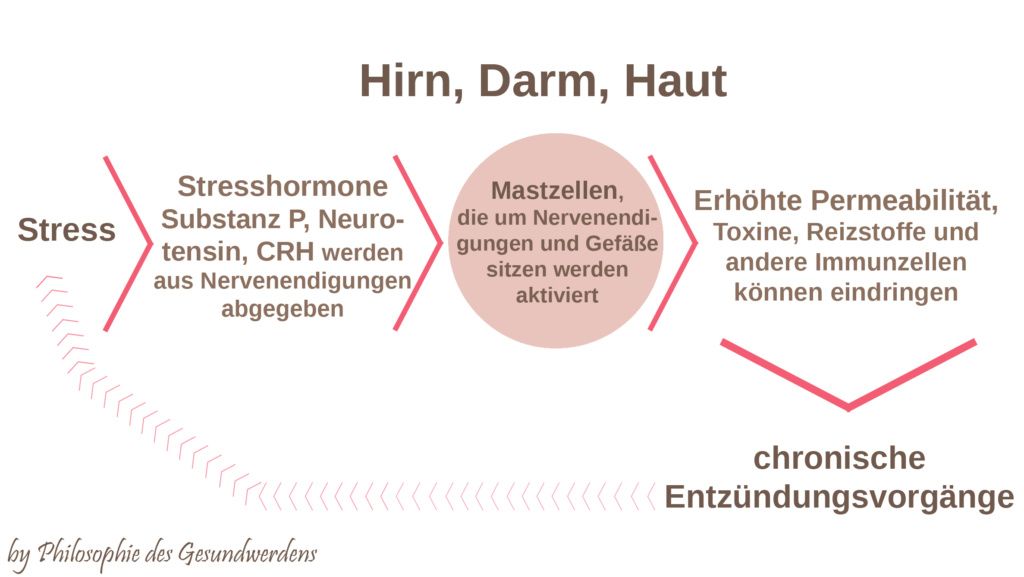
Stress sorgt also im Endeffekt für Gewebeschädigung! Die Mastzellen befinden sich in der Haut vor allem um sensorische Nervenendigungen angeordnet und rufen Juckreiz hervor, was dem veralteten Begriff „Neurodermitis“ im Grunde wieder seine Berechtigung gibt. Atopisches Ekzem wird (neben anderen mastzellinvollvierten Erkrankungen) in der Literatur inzwischen als neuroinflammatorische Erkrankung bezeichnet.
NT und Abweichungen in der HPA-Achsenfunktion spielen vermutlich darüber hinaus eine Rolle in der Pathogenese von ADHS, Depression und Schizophrenie.
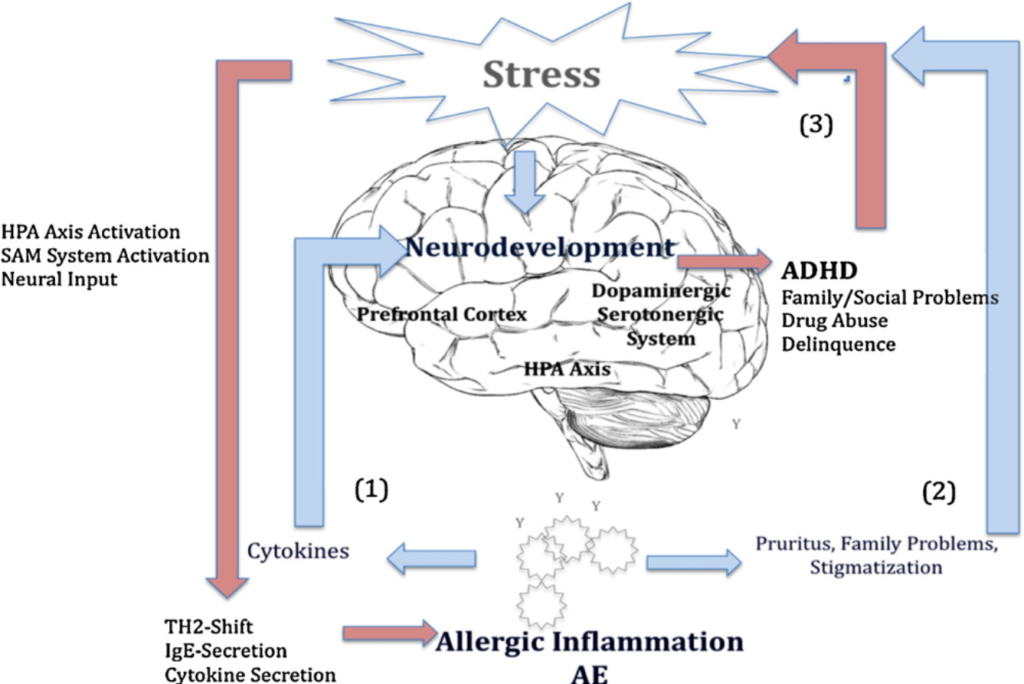
Die höchste Expression an NT-Rezeptoren im menschlichen Gehirn befindet sich in der Amygdala, unserem „Angstzentrum“ (Teil des limbischen Systems), dem Hypothalamus („Steuerzentrale des Gehirns“) und dem Broca-Areal. Hier werden Verhalten, Emotionen und Sprache reguliert. Dies ist eine entscheidende Information, denn Sprachverlust ist ein weiteres typisches Symptom bei Kindern mit schwerem Autismus.
Zu der Beteiligung der Mastzellen wurden schon etliche Studien mit verschiedenen Tierarten durchgeführt. Bei Versuchen mit Mäusen werden die Tiere gestresst durch Einsperren in ein enges Gefäß, das Halten in einem überfüllten Käfig, das Spritzen einer Salzlösung, schwimmen lassen in kaltem Wasser oder durch Stromschocks. Akuter Stress kann das Cytokin IL-6 und Histamin im Serum signifikant erhöhen. In einem Versuch mit Mäusemutanten, die keine Mastzellen besitzen, wird in solch einem Fall kein Anstieg von IL-6 verzeichnet, was zeigt, dass die Ausschüttung vollständig von Mastzellen abhängt. Wird Mäusen IL-6 verabreicht, kommt es zu autistischen Verhaltensänderungen. Mastozytosepatienten haben ein erhöhtes IL-6 Level, das mit dem Schweregrad der Erkrankung korreliert, und Kinder mit Mastozytose haben ein 10fach höheres Risiko, ASD zu entwickeln, als der Rest der Bevölkerung. In einem anderen Experiment mit Mäusen konnte eine Permeabilität (Durchlässigkeit) der Blut-Hirn-Schranke durch durch Stress getriggerte Mastzellen nachgewiesen werden. Der Effekt war nicht nur signifikant bei den Versuchstieren, die durch Einsperren in eine enge Vorrichtung für eine halbe Minute gestresst wurden, sogar bei den unbehelligten Kontrolltieren zeigte sich schon vermehrte Degranulation von Mastzellen, alleine dadurch dass sie in ein anderes Gebäude und in einen fremden Raum für die Messungen gebracht wurden. Bei vorherige Gabe des Mastzellblockers Cromoglicinsäure oder Histaminrezeptorantagonisten (Histaminblockern) wurde dieser Effekt negiert.
Umgekehrt können entzündliche Vorgänge im Körper (ausgelöst durch Verletzung, Pathogene, als Reaktion auf Toxine oder unverträgliche Nahrungsmittel,…) selbst das Stressempfinden hervorrufen, indem über IL-6 , Histamin und CRH aus Mastzellen oder anderen Immunzellen die HPA-Achse aktiviert wird, was zu einer Ausschüttung von Stresshormonen führt und anfälliger für Angststörungen macht, was dann erneut Mastzellen aktiviert, ein übler Teufelskreis.
In einer Studie mit von Migräne betroffenen Kindern nahmen die Häufigkeit und der Schweregrad von stressinduzierter Migräne ab, zusammen mit dem Mastzellmarker Tryptase, nachdem den Kindern Entspannungsmethoden beigebracht worden waren.
Frühkindlicher Stress kann zu einer Veränderung der ADHS-relevanten Neurotransmitter führen, wie zu einer Erhöhung der Catecholamine (z.B. Adrenalin) bei Misshandlung, geringer Eltern-Kind-Bindung und Trauma. Tägliche negative Erfahrungen können zu einem chronisch erhöhten Kortisollevel führen, was zu Entwicklungsproblemen in den für ADHS relevanten Gehirnstrukturen wie der präfrontale Cortex, der anteriore Gyrus cinguli oder der HPA-Achse führen kann, was gleichzeitig auch wieder dauerhaft anfällig für Stress macht, da der Körper „denkt“, man lebe in einer gefährliche Umwelt und sich darauf einstellen will. Dies sorgt immer für Überempfindlichkeiten in den einen und Unterentwicklung in anderen Hirnbereichen, was auch noch im Erwachsenenalter bei Dauerstress zu beobachten ist.
Zusammenfassend zeigen diese Erkenntnisse, dass während unseres Lebens, beginnend bei unserer Entstehung im Mutterleib, unser Nerven-, Hormon- und Immunsystem durch Umwelteinflüsse programmiert werden. Stress lässt diese Systeme in Richtung größerer Empfindlichkeit entwickeln, um uns in einer anscheinend gefahrenreichen Umwelt überlebensfähiger zu machen. Dies zeigt sich z.B. in einer stärkeren Gewebebildung in für Angst zuständigen Gehirnarealen, einer Unterentwicklung in anderen Bereichen und einer erhöhten Bildung und größerer Empfindlichkeit von Immunabwehrzellen. Am extremsten zeigt sich dieser Vorgang bei ASD-Betroffenen.
Diese Beobachtungen können durch Einbeziehung der Geschichte des Betroffenen wertvolle Erklärungen für die Entstehung gewisser Probleme liefern. Sie zeigen, dass zu schnell mit der Erklärung eines „Gendefekts“ abgespeist wird, womit der Betroffene und seine Angehörigen vollkommen entmutigt werden. Der Ansatz, der dem Menschen wirklich dient, ist ihm zu helfen, wieder in Einklang mit sich und seiner Umwelt zu kommen. Die Tatsache, dass unser Gehirn, wie wir heute wissen, plastisch (flexibel, im Wachstum) bleibt bis ins hohe Alter, soll nicht nur bislang Gesunde warnen, auf ein besseres Stressmanagment zu achten, sondern sie erklärt auch, weshalb Entspannungsmethoden wie Meditation und Yoga sich so positiv auf das Gehirn und die Bildung gesunder synaptischer Verbindungen in wichtigen Hirnarealen auswirkt, ebenso wie bei chronischen Erkrankungen aller übrigen Organe. Bei körperlichen sowie „psychischen oder psychiatrischen“ Erkrankungen ist es von daher immer wichtig, sich dem Problem von beiden Seiten zu nähern, also Körper UND Geist zu entlasten und zu stärken, um wirklich effektiv helfen zu können, da beides durch vielfältige Feedbackmechanismen aufeinander Einfluss nimmt. Entzündungs- und allergieberuhigende (also histaminsenkende und mastzellstabilisierende) Maßnahmen sind in jedem Fall angebracht. Durch Methoden wie Neurofeedbacktherapie und Soundtherapie konnten bei ASD-, ADHS- und von Depressionen Betroffene sehr gute Erfolge dahingehend erzielt werden, den Betroffenen aus der negativen Abwärtsspirale zu holen und das Gehirn regelrecht neu zu programmieren, was sich auch auf der übrigen körperlichen Ebene positiv niederschlägt.
Ich möchte daher jedem empfehlen, nicht nur Bewegung für den Körper, sondern auch ein förderliches „Hirntraining“ wie Achtsamkeitsübungen, autogenes Training, Qigong oder das Führen eines simplen Dankbarkeitstagebuchs in den Alltag zu integrieren für nachhaltige Gesundheit, und einfach auf einen Lebensstil zu achten, der einem gut tut. Für Kinder ist Lob und Bestärkung wichtig und ihnen von Anfang an einen guten Umgang mit schwierigen Situationen und ihren eigenen Gefühlen beizubringen.
Achte darüber hinaus nicht nur darauf, was du an Substanzen und Lebensmitteln in deinen Bauch lässt, sondern auch an „geistiger Nahrung“ zu dir nimmst.
Emotions are the nexus between mind and matter, going back and forth between the two and influencing both. ~ Candace Pert, Ph.D.
The biochemical molecules exist to make it possible for the soul to express and experience emotions via the body. ~Marc David
Literatur:
Peters, J. L., Cohen, S., Staudenmayer, J., Hosen, J., Platts‐Mills, T. A., & Wright, R. J. (2012). Prenatal negative life events increases cord blood IgE: interactions with dust mite allergen and maternal atopy. Allergy, 67(4), 545-551.
Kinney, D. K., Munir, K. M., Crowley, D. J., & Miller, A. M. (2008). Prenatal stress and risk for autism. Neuroscience & Biobehavioral Reviews, 32(8), 1519-1532.
Zelazo, P. R. (1997). Infant-Toddler Information Processing Assessment for Children with Pervasive Developmental Disorder and Autism: Part I. Infants & Young Children, 10(1), 1-14.
Nuckolls, K. B., Cassel, J., & Kaplan, B. H. (1972). Psychosocial assets, life crisis and the prognosis of pregnancy. American journal of Epidemiology, 95(5), 431-441.
Theoharides, T. C., Tsilioni, I., Patel, A. B., & Doyle, R. (2016). Atopic diseases and inflammation of the brain in the pathogenesis of autism spectrum disorders. Translational Psychiatry, 6(6), e844.
Von Hertzen, L. C. (2002). Maternal stress and T-cell differentiation of the developing immune system: possible implications for the development of asthma and atopy. Journal of Allergy and Clinical Immunology, 109(6), 923-928.
Angelidou, A., Francis, K., Vasiadi, M., Alysandratos, K. D., Zhang, B., Theoharides, A., … & Theoharides, T. C. (2010). Neurotensin is increased in serum of young children with autistic disorder. Journal of neuroinflammation, 7(1), 48.
Angelidou, A., Asadi, S., Alysandratos, K. D., Karagkouni, A., Kourembanas, S., & Theoharides, T. C. (2012). Perinatal stress, brain inflammation and risk of autism-review and proposal. BMC pediatrics, 12(1), 89.
Ronald, A., Pennell, C. E., & Whitehouse, A. J. (2011). Prenatal maternal stress associated with ADHD and autistic traits in early childhood. Frontiers in psychology, 1, 223.
Roberts, A. L., Koenen, K. C., Lyall, K., Robinson, E. B., & Weisskopf, M. G. (2015). Association of autistic traits in adulthood with childhood abuse, interpersonal victimization, and posttraumatic stress. Child abuse & neglect, 45, 135-142.
Roberts, A. L., Lyall, K., Rich-Edwards, J. W., Ascherio, A., & Weisskopf, M. G. (2013). Association of maternal exposure to childhood abuse with elevated risk for autism in offspring. JAMA psychiatry, 70(5), 508-515.
van Steensel, F. J., Bögels, S. M., & Perrin, S. (2011). Anxiety disorders in children and adolescents with autistic spectrum disorders: a meta-analysis. Clinical child and family psychology review, 14(3), 302.
Rodgers, J., Glod, M., Connolly, B., & McConachie, H. (2012). The relationship between anxiety and repetitive behaviours in autism spectrum disorder. Journal of autism and developmental disorders, 42(11), 2404-2409.
Hartmann, K., Escribano, L., Grattan, C., Brockow, K., Carter, M. C., Alvarez-Twose, I., … & Niedoszytko, M. (2016). Cutaneous manifestations in patients with mastocytosis: consensus report of the European Competence Network on Mastocytosis; the American Academy of Allergy, Asthma & Immunology; and the European Academy of Allergology and Clinical Immunology. Journal of Allergy and Clinical Immunology, 137(1), 35-45.
Theoharides, T. C., Enakuaa, S., Sismanopoulos, N., Asadi, S., Papadimas, E. C., Angelidou, A., & Alysandratos, K. D. (2012). Contribution of stress to asthma worsening through mast cell activation. Annals of Allergy, Asthma & Immunology, 109(1), 14-19.
Karagkouni, A., Alevizos, M., & Theoharides, T. C. (2013). Effect of stress on brain inflammation and multiple sclerosis. Autoimmunity reviews, 12(10), 947-953.
Huang, M., Pang, X., Karalis, K., & Theoharides, T. C. (2003). Stress-induced interleukin-6 release in mice is mast cell-dependent and more pronounced in Apolipoprotein E knockout mice. Cardiovascular Research, 59(1), 241-249.
SLOMINSKI, A., WORTSMAN, J., PISARCHIK, A., ZBYTEK, B., LINTON, E. A., MAZURKIEWICZ, J. E., & WEI, E. T. (2001). Cutaneous expression of corticotropin-releasing hormone (CRH), urocortin, and CRH receptors. The FASEB Journal, 15(10), 1678-1693.
Gillott, A., & Standen, P. J. (2007). Levels of anxiety and sources of
stress in adults with autism. Journal of Intellectual Disabilities,
11(4), 359–370.
Corbett, B. A., Schupp, C. W., Levine, S., & Mendoza, S. (2009). Comparing cortisol, stress, and sensory sensitivity in children with autism. Autism Research, 2(1), 39-49.
Corbett, B. A., Schupp, C. W., Simon, D., Ryan, N., & Mendoza, S. (2010). Elevated cortisol during play is associated with age and social engagement in children with autism. Molecular autism, 1(1), 13.
Zhang, B., Angelidou, A., Alysandratos, K. D., Vasiadi, M., Francis, K., Asadi, S., … & Theoharides, T. C. (2010). Mitochondrial DNA and anti-mitochondrial antibodies in serum of autistic children. Journal of neuroinflammation, 7(1), 80.
Buske-Kirschbaum, A., Fischbach, S., Rauh, W., Hanker, J., & Hellhammer, D. (2004). Increased responsiveness of the hypothalamus–pituitary–adrenal (HPA) axis to stress in newborns with atopic disposition. Psychoneuroendocrinology, 29(6), 705-711.
Buske-Kirschbaum, A., Schmitt, J., Plessow, F., Romanos, M., Weidinger, S., & Roessner, V. (2013). Psychoendocrine and psychoneuroimmunological mechanisms in the comorbidity of atopic eczema and attention deficit/hyperactivity disorder. Psychoneuroendocrinology, 38(1), 12-23.
Choi, E. H., Brown, B. E., Crumrine, D., Chang, S., Man, M. Q., Elias, P. M., & Feingold, K. R. (2005). Mechanisms by which psychologic stress alters cutaneous permeability barrier homeostasis and stratum corneum integrity. Journal of Investigative Dermatology, 124(3), 587-595.
Schmid-Ott, G., Jaeger, B., Meyera, S., Stephana, E., Kapp, A., & Werfel, T. (2001). Different expression of cytokine and membrane molecules by circulating lymphocytes on acute mental stress in patients with atopic dermatitis in comparison with healthy controls. Journal of allergy and clinical immunology, 108(3), 455-462.
Smith, S. E., Li, J., Garbett, K., Mirnics, K., & Patterson, P. H. (2007). Maternal immune activation alters fetal brain development through interleukin-6. Journal of Neuroscience, 27(40), 10695-10702.
Huang, M., Pang, X., Karalis, K., & Theoharides, T. C. (2003). Stress-induced interleukin-6 release in mice is mast cell-dependent and more pronounced in Apolipoprotein E knockout mice. Cardiovascular Research, 59(1), 241-249.
Theoharides, T. C., Zhang, B., & Conti, P. (2011). Decreased mitochondrial function and increased brain inflammation in bipolar disorder and other neuropsychiatric diseases. Journal of clinical psychopharmacology, 31(6), 685-687.
Esposito, P., Gheorghe, D., Kandere, K., Pang, X., Connolly, R., Jacobson, S., & Theoharides, T. C. (2001). Acute stress increases permeability of the blood–brain-barrier through activation of brain mast cells. Brain research, 888(1), 117-127.
Yirmiya, R., & Goshen, I. (2011). Immune modulation of learning, memory, neural plasticity and neurogenesis. Brain, behavior, and immunity, 25(2), 181-213.
Olness, K., Hall, H., Rozniecki, J. J., Schmidt, W., & Theoharides, T. C. (1999). Mast Cell Activation in Children With Migraine Before and After Training in Self‐regulation. Headache: The Journal of Head and Face Pain, 39(2), 101-107.
Gillott, A., & Standen, P. J. (2007). Levels of anxiety and sources of stress in adults with autism. Journal of intellectual disabilities, 11(4), 359-370.
Haut-Darm-Hirn-, Hochsensibilitäts- & Mastzell-Community – kostenfrei!
Bleibe auf dem Laufenden über neueste Beiträge, Rezepte, exklusive, zeitgemäße Lifestyletipps, aktuelle Events, erhalte Gutscheine & persönliche Einblicke, die ich nicht öffentlich mit jedem teile. Für einen leichten Einstieg erhältst du hier kostenlos dein Exemplar meines E-Books, das mit den wichtigsten Zusammenfassungen meines Blogs einen Einstieg in mein Konzept liefert, mit vielen Tipps, die du gleich im Alltag ausprobieren kannst.
Feedback zu meinem Newsletter:
"...tausend Dank wieder mal für deine Arbeit. Immer wieder helfen mir deine Videos wieder meinen inneren Frieden zu finden und nicht so hart mit mir ins Gericht zu gehen."
Trage dich hier ein für Doro´s Newsletter + kostenloses E-Book + NEU Heilungsvisualisation MP3:


Pingback: Die 12 Arten von Stress – Philosophie des Gesundwerdens
Pingback: Interview: Gupta-Coach Ursula Rothamel über Amygdala Retraining – Philosophie des Gesundwerdens
Pingback: Dysautonomie – wenn das vegetative Nervensystem aus dem Gleichgewicht gerät – Philosophie des Gesundwerdens
Pingback: Entscheidungen, die dein Leben verändern können – Philosophie des Gesundwerdens
Pingback: Warum Meditation und Achtsamkeit bei dir nicht wirken oder sogar Probleme bereiten könnte – Philosophie des Gesundwerdens
Pingback: Wenn alles zuviel wird – der beste Tipp einer Aspergerin – Philosophie des Gesundwerdens
Pingback: Gastbeitrag: Sandras Reise mit der Rosazea – Philosophie des Gesundwerdens
Pingback: Heilt die Zeit alle Wunden? – Philosophie des Gesundwerdens
Pingback: Wie kannst du deinen Vagusnerv im Alltag unterstützen? – Philosophie des Gesundwerdens