Während der letzten 20 Jahre ist es zu einem starken Anstieg von Autismus Spektrum Störungen (autism spectrum disorder, ASD) gekommen, mit einer derzeitigen Prävalenz von etwa 1 in 100 Kindern. ASD zeichnet sich aus durch verschiedene Defizite im kognitiven, Sprach- und sozialen Bereich, sowie stereotypem Verhalten. ASD manifestiert sich während der Kindheit, bei mindestens 30% mit plötzlichem, klinischen Entwicklungsrückschritt.
Bislang war man sich über die Ursachen noch im Unklaren. Es konnten eine Vielzahl an Genen und Veränderungen in Gehirnstrukturen bei Betroffenen nachgewiesen werden, die im Zusammenhang mit der Erkrankung stehen sollen, diese Auffälligkeiten sind von Betroffenem zu Betroffenem allerdings sehr unterschiedlich, sodass hier keine wirkliche Aussage getroffen werden kann und es vor allem in Bezug auf praktische Ansätze, Behandlungsmethoden und Hilfe für die betroffenen Familien noch keinen wirklichen Fortschritt gebracht hat.
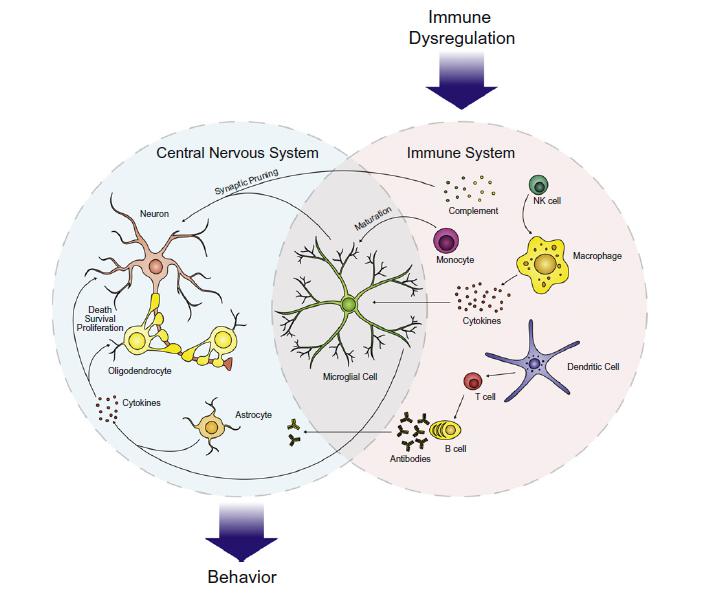
Inzwischen weiß man, dass auch perinatale, Umwelt-, infektiöse und immunologische Faktoren eine große Rolle spielen, und das Risiko für ASD erhöhen bzw. zu der Pathogenese beitragen. Alle unsere Organsysteme befinden sich in einem ständigen Informationsaustausch, sie sind verbunden über das Hormon-, Nerven- und Immunsystem, um auf Veränderungen und Herausforderungen in der Umwelt reagieren zu können. Immunzellen sind direkt in Gewebemodellierung, ja sogar in die Bildung neuer synaptischer Verbindungen involviert. Besonders in unserem Gehirn ist es notwendig, dass ständig auf die Umwelt und Signale aus dem gesamten Körper reagiert wird, sonst wäre ein Lernverhalten und Gedächtnisbildung nicht möglich. Dies macht es natürlich anfällig für Störungen. Infektionen mit Viren, Bakterien, Parasiten und Pilzen, Allergien sowie das Ausgesetztsein von Toxinen können auf diesem Wege nachgewiesenermaßen einen negativen Einfluss auf kognitive Prozesse nehmen. Aber auch direkte Einwirkungen auf das Gehirn durch Schädeltrauma, Strahlung und psychischen Stress wirken alarmierend auf das Immunsystem.
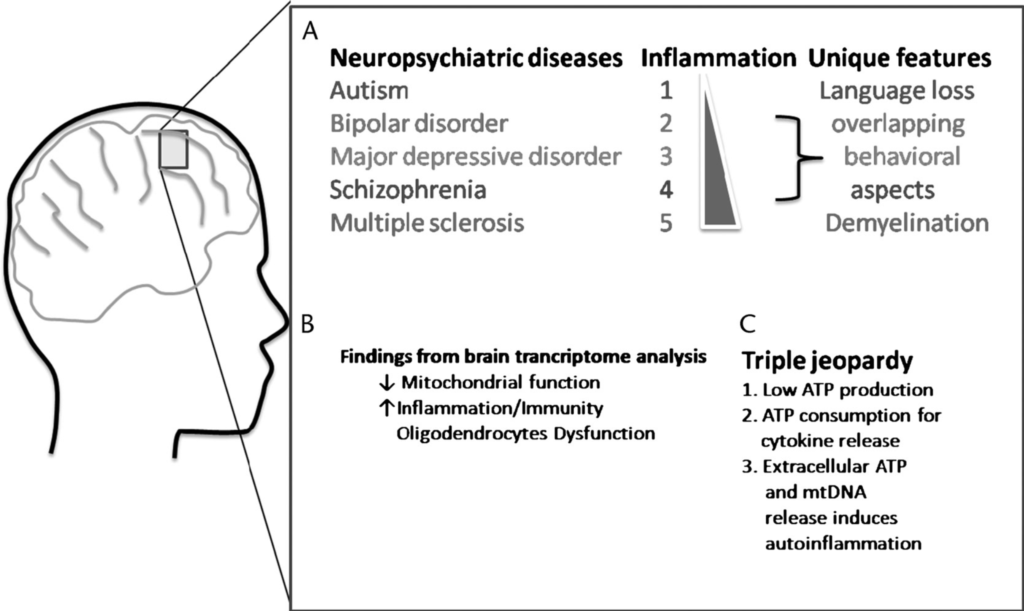
Dieser Ansatz kann eine Erklärung für plötzliche Rückschritte in der Entwicklung eines Kindes liefern. Immer mehr Untersuchungen zeigen, dass eine chronische Hirnentzündung zu der Pathogenese von neuropsychiatrischen Erkrankungen, eingeschlossen ASD, beitragen kann.
Eine ASD-Erkrankung geht für gewöhnlich mit gewissen immun- und autoimmun Komponenten einher, sowie mit oxidativem Stress, durch einen gestörten Schwefelmetabolismus. Basisches Myelinprotein konnte in der Gehirn-Rückenmarksflüssigkeit nachgewiesen werden, was auch bei Schlaganfällen, Schädel-Hirn-Traumata und Multipler Sklerose, einer das Gehirn betreffenden Autoimmunerkrankung, der Fall ist. Autoantikörper, die sich gegen fötale Hirnproteine richten, konnten bei ca. 12% der Müttern mit ASD-betroffenen Kindern nachgewiesen werden. Diese könnten während der Schwangerschaft für eine Schädigung des Fötus gesorgt haben. Sie wurden ebenfalls bei 30-70% der ASD-Patienten nachgewiesen. Dies weißt auf eine Störung der Blut-Hirn-Schranke hin, die durch Mastzellen reguliert wird. Des weiteren korrelieren die Gehirn-Autoantikörper signifikant mit allergischen Symptomen, für die ebenfalls Mastzellen verantwortlich sind. Mastzellen spielen eine bedeutende Rolle in der Entwicklung von Allergien, der Immunität und Entzündungsreaktionen.
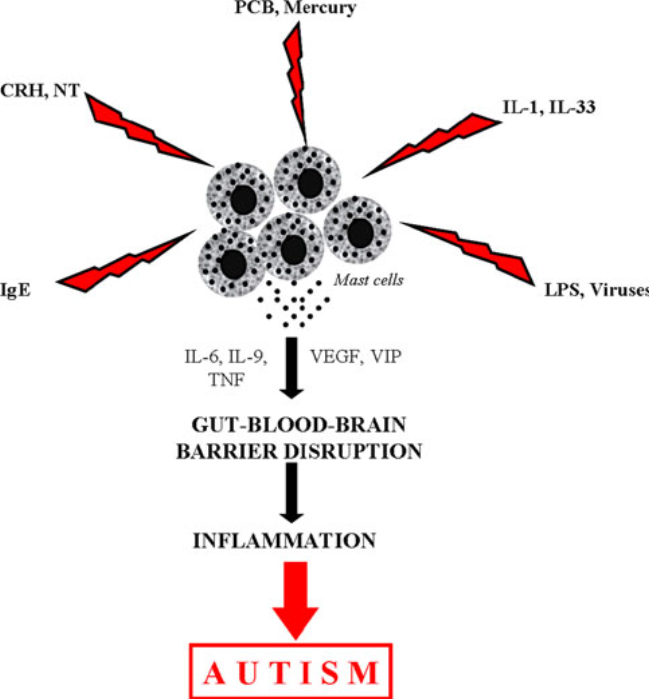
Weiter Infos über Mastzellen findest du hier.
Eine gestörte Blut-Hirn-Schranke ermöglicht ebenso das Eindringen von für das Hirn toxischen Stoffen aus dem restlichen Körper. Auch bei Multipler Sklerose, einer anderen entzündlichen Gehirnerkrankung, zeigt sich den ersten Symptomen vorausgehend eine Störung in der Blut-Hirn-Schranke.
Untersuchungen an verstorbenen ASD-Betroffenen zeigten deutliche Zeichen chronischer Entzündungsvorgänge im Gehirn, aber auch im restlichen Körper.
Immunzellen reagieren nicht nur auf Umweltfaktoren, sie helfen auch bei der Hirnentwicklung, Gedächtnisbildung und Lernverhalten. Bei ASD-Betroffenen können starke Abweichungen in der angeborenen sowie adaptierten Immunantwort nachgewiesen werden. Natürliche Killerzellen und Monozyten zeigen eine erhöhte Aktivität. Immunglobulinprofile und das Komplementsystem zeigen starke Abweichungen von den Normwerten.
Cytokine sind modulatorische Moleküle des Immunsystems, die Einfluss auf die Entwicklung von Immunzellen nehmen. Sie werden von Immunzellen wie Mastzellen freigesetzt, und können entzündungsfördernde oder regulatorische Wirkung haben. Sie können je nach Umständen positiven wie negativen Einfluss auf unser Gewebe und Organe, einschließlich des Gehirns, nehmen. Unsere Gehirnzellen besitzen zahlreiche Rezeptoren für Cytokine. Ein abnormales Cytokinprofil wurde bereits für Depressionen und Schizophrenie nachgewiesen. Eine ganze Reihe an entzündungsfördernden Cytokinen wird im Gehirn und der Gehirn-Rückenmarksflüssigkeit ASD-Betroffener für gewöhnlich als erhöht angezeigt, während gleichzeitig regulatorische Cytokine zu niedrig sind. Sie korrelieren mit auffälligem Verhalten wie gestörter Kommunikation und Entwicklungsrückschritten. Bei Kindern, die im fortgeschrittenen Alter einen plötzlichen Entwicklungsrückschritt machten, zeigen sich hier größere Auffälligkeiten als bei Kindern, deren ASD-Entwicklung frühzeitig einsetzte. Auch konnten Korrelationen von erhöhten Cytokinwerten mit Begleitsymptomen wie Lethargie, Stereotypie und Hyperaktivität festgestellt werden.
Besonders die Cytokine TNF-a, IL-1β IL-4 und IL-6 stehen im direkten Zusammenhang mit schwerem Autismus. Erhöhte Werte von IFN-γ, IL-4 und IL-5 bei der Mutter während der Schwangerschaft sind assoziiert mit einem 50% erhöhten Risiko für ASD.
Von Mastzellen ausgestoßene Cytokine können zu einer Aktivierung von Th17-abhängigen Neutrophilen führen. In einer Studie, bei der bei einem Mausmodell Th17-Zellen bei Mäusemüttern entfernt wurden, führte dies zu einer Verhinderung der Entwicklung von autistischem Verhalten bei den Nachkommen.
Das Cytokin GM-CSF ist oftmals stark erhöht und es wird vermutet, dass es eine wichtige Rolle bei Autoimmunerkrankungen spielt. Es erhöht Th17-Entwicklung und kann die Blut-Hirn-Schranke überwinden. Noch lässt sich allerdings nicht sagen, ob es direkt entzündlich wirkt oder nur als Folge eines Entzündungsprozesses ausgeschüttet wird, um Reparaturvorgänge einzuleiten.
„Cytokin-Anstürme“ können eine Überreizung der Neuronen bewirken und zu Krampfanfällen und schließlich Absterben von Nervenzellen führen.
Auch Mastozytosepatienten haben ein erhöhtes IL-6 Level, das mit dem Schweregrad der Erkrankung korreliert und Kinder mit Mastozytose haben ein 10fach höheres Risiko ASD zu entwickeln als der Rest der Bevölkerung. Akuter Stress kann IL-6 im Serum signifikant erhöhen. Hohe IL-6 Level, vor allem im Zusammenhang mit gewissen chronischen Erkrankungen und Alterung, gehen einher mit Gedächtnisproblemen. In einzelnen Studien wurden allerdings auch neuroprotektive Effekte durch IL-6-Gabe verzeichnet. Ähnliches gilt für TNF-a. Man vermutet, dass sie unter normalen Bedingungen, z.B. in der Entwicklung, einen negativen Effekt haben, während sie in einem Organismus, der bereits stark aus dem Gleichgewicht geraten ist bei bestimmten Erkrankungen, einen Beitrag zur Wiederbringung der Balance leisten können, indem sie wiederum hemmend auf andere schädliche Stoffe wirken. Eine Betrachtung isolierter Komponenten ist von daher vermutlich nicht zielführend.
TGF-beta1 wurde als niedrig in Gehirnen von autistischen Kindern nachgewiesen, was eine interessante Entdeckung ist, da TGF-beta1 mastzellinhibierend wirkt. Mononukleäre Zellen bei autistischen Patienten produzierten in einer Studie zweimal soviel vom Entzündungsmarker TNF im Vergleich zur Kontrollgruppe, wenn sie durch das Weizenprotein Gliadin, Kuhmilchprotein oder Soja stimuliert wurden.
Periphere Cytokine (z.B. aus dem Darm) können auch auf das ZNS Einfluss nehmen über Stimulierung des vagalen Nervs (Nervus vagus, zehnter Hirnnerv).
Entzündungsfördernde Cytokine führen weiterhin zu einem veränderten Neurotransmittermetabolismus, betroffen sind vor allem Norepinephrin (erhöht) und Dopamin (erniedrigt), was typisch bei ADHS-Symptomatik ist.
Bei ASD-Betroffenen wurde oftmals eine Th2-Dominanz („allergisch“) oder Th1-Dominanz („autoimmun“) festgestellt. Bei einer Th2-Dominanz ist eine bessere Entwicklung in Bezug auf Verhalten und Entwicklung wahrscheinlich.
Desweiteren konnte bei ASD-Kindern eine ungewöhnlich verringerte Immunantwort auf bestimmte Antigene, z.B. aus Impfstoffen festgestellt werden, was ebenfalls auf ein Ungleichgewicht schließen lässt.
Bei 60% der ASD-Betroffenen ist darüber hinaus eine mitochondriale Dysfunktion zu beobachten, das heißt, die „Kraftwerke“ ihrer Zellen produzieren nicht genug Energie für das Gehirn, eine Folge von entzündlichen Prozessen.
Mikrogliazellen sind neben Mastzellen die Immunzellen des Gehirns. Abnormale Mikrogliaaktivitäten und -proliferation (Vermehrung) kann zu lokaler Entzündung und Unterdrückung von Signalen führen und wurde bei ASD-Patienten nachgewiesen.
Das Stresshormon Neurotensin stimuliert die Proliferation von Mikroglia und Mastzellen und wirkt neurotoxisch auf corticale Neuronen. Mastzellen stimulieren ebenfalls Mikroglia, und zwar über Histamin und Tryptase, womit sie ebenfalls zu Neuroinflammation (Hirnentzündung) beitragen. Auch eine erhöhte Aktivität von Astroglia konnte in der Großhirnrinde sowie Cerebellum festgestellt werden.
Auch in Bezug auf ADHS werden zunehmend Bestätigungen zusammengetragen, dass allergische und immunologische Reaktionen an der Entstehung beteiligt sind.
Behandlungsansätze
Diese sehr neuen Erkenntnisse zeigen, dass immunmodulierende Behandlungen sehr hoffnungsversprechend sind in Bezug auf ASD und andere neuropsychiatrische Erkrankungen. Es wurden dahingehend schon vielversprechende Ansätze geleistet, weitere Studien werden in den nächsten Jahren genauere Antworten liefern. Eine Studie aus dem Jahr 1989 kommt bereits zu dem Schluss, dass Antihistaminika bei ADHS hilfreich sein können!
Interessant fand ich persönlich die Ansätze mit natürlichen Wirkstoffen. So sind die Behandlung mit dem schwefelhaltigen Antioxidans Sulforaphan, das aus Brokkoli gewonnen wird, erfolgreich gewesen bei der Verbesserung von Kommunikation und sozialer Interaktion. Sulforaphan kommt allgemein im hohen Maß in Kohlgemüse vor, die höchste Konzentration ist in Brokkolisprossen zu finden.
Stoffe aus der Kurkumaknolle können helfen, IL-6 Werte zu senken.
Die Verabreichung von N-Acetylcystein, ein Abkömmling der wichtigen schwefelhaltigen Aminosäure Cystein und Vorläufer des Masterantioxodanz Glutathion und wichtig für den Schwefelmetabolismus, sowie das Antioxidant S-Adenosylmethionin (SAMe), von dem in der Regel ein Mangel herrscht aufgrund des oxidativen Stresses, konnte eine Verringerung von Hypersensitivität und anderen Symptomen bei Kindern bewirken.
Lies hier über die 12 Arten von Stress!
Die Arbeitsgruppe des Mastzellexperten Prof. Theoharis C. Theoharides untersucht seit längerem die Wirkung von natürlichen Flavonoiden, besonders Luteolin und Quercetin. Bei Versuchen erreichten sie eine signifikante Verbesserung im Verhalten von Kindern und Erwachsenen in Bezug auf Aufmerksamkeit, Kommunikation, „Hirnnebel“ (brainfog), Gedächtnis und Verhalten. Ein antidepressiver Effekt konnte ebenfalls nachgewiesen werden. Besonders TNF- und IL-6 Werte konnten deutlich gesenkt werden. Luteolin inhibiert die Aktivität und Vermehrung von Mikroglia und wirkt neuroprotektiv (nervenschützend). Es verhindert außerdem, dass IgE, mitochondriale Bestandteile und Quecksilber Mastzellen aktivieren und wirkt antioxidativ, reduziert also oxidativen Stress. Es wirkt sich desweiteren positiv bei Multipler Sklerose aus, indem es mononukleäre Zellen blockiert. Luteolin kommt natürlicherweise vor in grünen Pflanzen, Artischocken, Kräutern wie Kamille, Kernen und Olivenöl. Das chemisch ähnliche Quercetin inhibiert unter anderem die Freisetzung von Histamin, Tryptase, IL-6 und TNF aus Mastzellen.
Hier findest du das von Prof. Theoharides entwickelte Supplement „Neuroprotek“. Ich bin über die Seite vom lowhistaminechef Yasmina Ykelenstam darauf gestoßen und hatte es mir von meiner USA-Reise mitgebracht. Das Supplement ist im Allgemeinen hypoallergen und mit sehr reinen Inhaltsstoffen, extra abgestimmt für die Empfindlichsten unter den Empfindlichen (autistische Kinder), bei einer Sensitivität auf Phenole und Salicylate soll das Supplement sicherheitshalber sehr langsam und vorsichtig eingeschlichen werden. Ich habe es allerdings zu einem Zeitpunkt genommen, als es mir ohnehin schon deutlich besser ging und stets weiter Fortschritte machte, weswegen ich jetzt nicht mehr sagen kann, als dass es mir nicht geschadet hat (und mein Körper beschwert sich immer recht verlässlich, wenn ihm ein Supplement nicht gut tut), auf jeden Fall schwören viele Mastzellerkrankte darauf. Bei starker Empfindlichkeit gegen Phenole empfiehlt Prof. Theoharides das Supplementieren mit Schwefelkomponenten wie Cystin, Taurin oder MSM sowie Methylgruppenspendern.
Fazit: Die aktuellen Studien zeigen, dass entzündliche und immunologische Vorgänge im Gehirn eine wichtige Rolle in der Pathogenese von ASD spielen, zumindest bei einer Untergruppe von Betroffenen. Daraus ergeben sich als derzeit beste Maßnahmen, gegen die allergischen Symptome vorzugehen, die Durchlässigkeit der Blut-Hirn-Schranke zu verringern, Mastzellen zu stabilisieren und gegen die chronische Entzündung vorzugehen. Entsprechende Pharmazeutika werden inzwischen eingesetzt, aber auch die genannten, natürlichen Stoffe zeigen eine oftmals ebenso starke Wirkung und sollten deswegen als hoffnungsversprechende Wirkstoffe weiter untersucht werden und bieten aktuell Betroffenen mit kognitiven Beschwerden (nicht nur bei ASD und ADHS) einen wertvollen Ansatz.
Viele wertvolle Informationen zur allgemeinen Senkung deines chronischen Entzündungslevels und wie du deinen Körper wieder in die Balance bringst, um deine Selbstheilungskräfte zu aktivieren, findest du auf meinem Blog!
All along the history of medicine, the really great physicians were peculiarly free from the bondage of drugs. ~Sir William Osler
My purpose is not to condemn the practice of psychoanalysis, but to call attention to what may be the primary physical causes of mental effects which the psychiatrist treats on the mental plane. If the primary cause is physical its treatment should be physical, and in such a case psychiatric treatment can be harmful as a primary measure. ~Arthur F. Coca, M.D
Literatur:
Theoharides, T. C., Asadi, S., & Patel, A. B. (2013). Focal brain inflammation and autism. Journal of neuroinflammation, 10(1), 46.
Le Belle, J. E., Sperry, J., Ngo, A., Ghochani, Y., Laks, D. R., López-Aranda, M., … & Kornblum, H. I. (2014). Maternal inflammation contributes to brain overgrowth and autism-associated behaviors through altered redox signaling in stem and progenitor cells. Stem cell reports, 3(5), 725-734.
Ashwood, P., & Van de Water, J. (2004). Is autism an autoimmune disease?. Autoimmunity Reviews, 3(7), 557-562.
Onore, C., Careaga, M., & Ashwood, P. (2012). The role of immune dysfunction in the pathophysiology of autism. Brain, behavior, and immunity, 26(3), 383-392.
Di Filippo, M., Sarchielli, P., Picconi, B., & Calabresi, P. (2008). Neuroinflammation and synaptic plasticity: theoretical basis for a novel, immune-centred, therapeutic approach to neurological disorders. Trends in pharmacological sciences, 29(8), 402-412.
Angelidou, A., Asadi, S., Alysandratos, K. D., Karagkouni, A., Kourembanas, S., & Theoharides, T. C. (2012). Perinatal stress, brain inflammation and risk of autism-review and proposal. BMC pediatrics, 12(1), 89.
Hagberg, H., Gressens, P., & Mallard, C. (2012). Inflammation during fetal and neonatal life: implications for neurologic and neuropsychiatric disease in children and adults. Annals of neurology, 71(4), 444-457.
Estes, M. L., & McAllister, A. K. (2015). Immune mediators in the brain and peripheral tissues in autism spectrum disorder. Nature Reviews Neuroscience, 16(8), 469-486.
Bauman, M. D., Iosif, A. M., Smith, S. E., Bregere, C., Amaral, D. G., & Patterson, P. H. (2014). Activation of the maternal immune system during pregnancy alters behavioral development of rhesus monkey offspring. Biological psychiatry, 75(4), 332-341.
Braunschweig, D., & Van de Water, J. (2012). Maternal autoantibodies in autism. Archives of neurology, 69(6), 693-699.
Zimmerman, A. W., Connors, S. L., Matteson, K. J., Lee, L. C., Singer, H. S., Castaneda, J. A., & Pearce, D. A. (2007). Maternal antibrain antibodies in autism. Brain, behavior, and immunity, 21(3), 351-357.
Rossi, C. C., Van de Water, J., Rogers, S. J., & Amaral, D. G. (2011). Detection of plasma autoantibodies to brain tissue in young children with and without autism spectrum disorders. Brain, behavior, and immunity, 25(6), 1123-1135.
Esposito, P., Chandler, N., Kandere, K., Basu, S., Jacobson, S., Connolly, R., … & Theoharides, T. C. (2002). Corticotropin-releasing hormone and brain mast cells regulate blood-brain-barrier permeability induced by acute stress. Journal of Pharmacology and Experimental Therapeutics, 303(3), 1061-1066.
Ribatti, D. (2015). The crucial role of mast cells in blood–brain barrier alterations. Experimental cell research, 338(1), 119-125.
Mostafa, G. A., & Al-Ayadhi, L. Y. (2013). The possible relationship between allergic manifestations and elevated serum levels of brain specific auto-antibodies in autistic children. Journal of neuroimmunology, 261(1), 77-81.
Zimmerman, A. W., Jyonouchi, H., Comi, A. M., Connors, S. L., Milstien, S., Varsou, A., & Heyes, M. P. (2005). Cerebrospinal fluid and serum markers of inflammation in autism. Pediatric neurology, 33(3), 195-201.
Li, X., Chauhan, A., Sheikh, A. M., Patil, S., Chauhan, V., Li, X. M., … & Malik, M. (2009). Elevated immune response in the brain of autistic patients. Journal of neuroimmunology, 207(1), 111-116.
Tsilioni, I., Taliou, A., Francis, K., & Theoharides, T. C. (2015). Children with autism spectrum disorders, who improved with a luteolin-containing dietary formulation, show reduced serum levels of TNF and IL-6. Translational psychiatry, 5(9), e647.
Ashwood, P., Krakowiak, P., Hertz-Picciotto, I., Hansen, R., Pessah, I., & Van de Water, J. (2011). Elevated plasma cytokines in autism spectrum disorders provide evidence of immune dysfunction and are associated with impaired behavioral outcome. Brain, behavior, and immunity, 25(1), 40-45.
Krakowiak, P., Goines, P. E., Tancredi, D. J., Ashwood, P., Hansen, R. L., Hertz-Picciotto, I., & Van de Water, J. (2015). Neonatal cytokine profiles associated with autism spectrum disorder. Biological psychiatry.
Goines, P. E., Croen, L. A., Braunschweig, D., Yoshida, C. K., Grether, J., Hansen, R., … & Van de Water, J. (2011). Increased midgestational IFN-γ, IL-4 and IL-5 in women bearing a child with autism: a case-control study. Molecular autism, 2(1), 13.
Nakae, S., Suto, H., Berry, G. J., & Galli, S. J. (2007). Mast cell–derived TNF can promote Th17 cell–dependent neutrophil recruitment in ovalbumin-challenged OTII mice. Blood,
Choi, G. B., Yim, Y. S., Wong, H., Kim, S., Kim, H., Kim, S. V., … & Huh, J. R. (2016). The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring. Science, 351(6276), 933-939.
Theoharides, T. C. (2009). Autism spectrum disorders and mastocytosis.
Theoharides, T. C., Boucher, W., & Spear, K. (2002). Serum interleukin-6 reflects disease severity and osteoporosis in mastocytosis patients. International archives of allergy and immunology, 128(4), 344-350.
Brockow, K., Akin, C., Huber, M., & Metcalfe, D. D. (2005). IL-6 levels predict disease variant and extent of organ involvement in patients with mastocytosis. Clinical immunology, 115(2), 216-223.
Mayado, A., Teodosio, C., Garcia-Montero, A. C., Matito, A., Rodriguez-Caballero, A., Morgado, J. M., … & Matarraz, S. (2016). Increased IL6 plasma levels in indolent systemic mastocytosis patients are associated with high risk of disease progression. Leukemia, 30(1), 124-130.
Huang, M., Pang, X., Karalis, K., & Theoharides, T. C. (2003). Stress-induced interleukin-6 release in mice is mast cell-dependent and more pronounced in Apolipoprotein E knockout mice. Cardiovascular Research, 59(1), 241-249.
Cohly, H. H. P., & Panja, A. (2005). Immunological findings in autism. International review of neurobiology, 71, 317-341.
Gomez, G., Ramirez, C. D., Rivera, J., Patel, M., Norozian, F., Wright, H. V., … & Kepley, C. L. (2005). TGF-β1 inhibits mast cell FcεRI expression. The Journal of Immunology, 174(10), 5987-5993.
Kashyap, M., Bailey, D. P., Gomez, G., Rivera, J., Huff, T. F., & Ryan, J. J. (2005). TGF-β 1 inhibits late-stage mast cell maturation. Experimental hematology, 33(11), 1281-1291.
Jyonouchi, H., Sun, S., & Le, H. (2001). Proinflammatory and regulatory cytokine production associated with innate and adaptive immune responses in children with autism spectrum disorders and developmental regression. Journal of neuroimmunology, 120(1), 170-179.
Vargas, D. L., Nascimbene, C., Krishnan, C., Zimmerman, A. W., & Pardo, C. A. (2005). Neuroglial activation and neuroinflammation in the brain of patients with autism. Annals of neurology, 57(1), 67-81.
Morgan, J. T., Chana, G., Pardo, C. A., Achim, C., Semendeferi, K., Buckwalter, J., … & Everall, I. P. (2010). Microglial activation and increased microglial density observed in the dorsolateral prefrontal cortex in autism. Biological psychiatry, 68(4), 368-376.
Morgan, J. T., Barger, N., Amaral, D. G., & Schumann, C. M. (2014). Stereological study of amygdala glial populations in adolescents and adults with autism spectrum disorder. PloS one, 9(10), e110356.
Patel, A., Tsilioni, I., & Theoharides, T. (2015). Neurotensin and Corticotropin-releasing Hormone Synergistically Activate Human Microglia through Mammalian Target of Rapamycin Complex 1 (mTORC1). The FASEB Journal, 29(1 Supplement), 888-18.
D Skaper, S., Facci, L., & Giusti, P. (2014). Neuroinflammation, microglia and mast cells in the pathophysiology of neurocognitive disorders: a review. CNS & Neurological Disorders-Drug Targets (Formerly Current Drug Targets-CNS & Neurological Disorders), 13(10), 1654-1666.
Dong, H., Zhang, X., Wang, Y., Zhou, X., Qian, Y., & Zhang, S. (2016). Suppression of brain mast cells degranulation inhibits microglial activation and central nervous system inflammation. Molecular neurobiology, 1-11.
Singh, K., Connors, S. L., Macklin, E. A., Smith, K. D., Fahey, J. W., Talalay, P., & Zimmerman, A. W. (2014). Sulforaphane treatment of autism spectrum disorder (ASD). Proceedings of the National Academy of Sciences, 111(43), 15550-15555.
Hardan, A. Y., Fung, L. K., Libove, R. A., Obukhanych, T. V., Nair, S., Herzenberg, L. A., … & Tirouvanziam, R. (2012). A randomized controlled pilot trial of oral N-acetylcysteine in children with autism. Biological psychiatry, 71(11), 956-961.
Singh, V. K., Warren, R. P., Odell, J. D., Warren, W. L., & Cole, P. (1993). Antibodies to myelin basic protein in children with autistic behavior. Brain, behavior, and immunity, 7(1), 97-103.
Angelidou, A., Alysandratos, K. D., Asadi, S., Zhang, B., Francis, K., Vasiadi, M., … & Theoharides, T. C. (2011). Brief report:“allergic symptoms” in children with autism spectrum disorders. More than meets the eye?. Journal of autism and developmental disorders, 41(11), 1579-1585.
Minagar, A., & Alexander, J. S. (2003). Blood-brain barrier disruption in multiple sclerosis. Multiple Sclerosis Journal, 9(6), 540-549.
Marshall, P. (1989). Attention deficit disorder and allergy: a neurochemical model of the relation between the illnesses. Psychological bulletin, 106(3), 434.
Gupta, S., Aggarwal, S., Rashanravan, B., & Lee, T. (1998). Th1-and Th2-like cytokines in CD4+ and CD8+ T cells in autism. Journal of neuroimmunology, 85(1), 106-109.
Jyonouchi, H., Sun, S., & Le, H. (2001). Proinflammatory and regulatory cytokine production associated with innate and adaptive immune responses in children with autism spectrum disorders and developmental regression. Journal of neuroimmunology, 120(1), 170-179.
Jyonouchi, H., Sun, S., & Itokazu, N. (2002). Innate immunity associated with inflammatory responses and cytokine production against common dietary proteins in patients with autism spectrum disorder. Neuropsychobiology, 46(2), 76-84.
Kempuraj, D., Tagen, M., Iliopoulou, B. P., Clemons, A., Vasiadi, M., Boucher, W., … & Theoharides, T. C. (2008). Luteolin inhibits myelin basic protein‐induced human mast cell activation and mast cell‐dependent stimulation of Jurkat T cells. British journal of pharmacology, 155(7), 1076-1084.
Asadi, S., Zhang, B., Weng, Z., Angelidou, A., Kempuraj, D., Alysandratos, K. D., & Theoharides, T. C. (2010). Luteolin and thiosalicylate inhibit HgCl2 and thimerosal-induced VEGF release from human mast cells. International journal of immunopathology and pharmacology, 23(4), 1015-1020.
Goines, P., & Van de Water, J. (2010). The immune system’s role in the biology of autism. Current opinion in neurology, 23(2), 111.
Vargas, D. L., Nascimbene, C., Krishnan, C., Zimmerman, A. W., & Pardo, C. A. (2005). Neuroglial activation and neuroinflammation in the brain of patients with autism. Annals of neurology, 57(1), 67-81.
Ashwood, P., Krakowiak, P., Hertz-Picciotto, I., Hansen, R., Pessah, I. N., & Van de Water, J. (2011). Altered T cell responses in children with autism. Brain, behavior, and immunity, 25(5), 840-849.
Theoharides, T. C., Zhang, B., & Conti, P. (2011). Decreased mitochondrial function and increased brain inflammation in bipolar disorder and other neuropsychiatric diseases. Journal of clinical psychopharmacology, 31(6), 685-687.
Yirmiya, R., & Goshen, I. (2011). Immune modulation of learning, memory, neural plasticity and neurogenesis. Brain, behavior, and immunity, 25(2), 181-213.
Buske-Kirschbaum, A., Schmitt, J., Plessow, F., Romanos, M., Weidinger, S., & Roessner, V. (2013). Psychoendocrine and psychoneuroimmunological mechanisms in the comorbidity of atopic eczema and attention deficit/hyperactivity disorder. Psychoneuroendocrinology, 38(1), 12-23.
Haut-Darm-Hirn-, Hochsensibilitäts- & Mastzell-Community – kostenfrei!
Bleibe auf dem Laufenden über neueste Beiträge, Rezepte, exklusive, zeitgemäße Lifestyletipps, aktuelle Events, erhalte Gutscheine & persönliche Einblicke, die ich nicht öffentlich mit jedem teile. Für einen leichten Einstieg erhältst du hier kostenlos dein Exemplar meines E-Books, das mit den wichtigsten Zusammenfassungen meines Blogs einen Einstieg in mein Konzept liefert, mit vielen Tipps, die du gleich im Alltag ausprobieren kannst.
Feedback zu meinem Newsletter:
"...tausend Dank wieder mal für deine Arbeit. Immer wieder helfen mir deine Videos wieder meinen inneren Frieden zu finden und nicht so hart mit mir ins Gericht zu gehen."
Trage dich hier ein für Doro´s Newsletter + kostenloses E-Book + NEU Heilungsvisualisation MP3:


Pingback: Die 12 Arten von Stress – Philosophie des Gesundwerdens
Pingback: Interview mit Monika Szelag: Psychische Gesundheit, unser Gesundheitssystem – Philosophie des Gesundwerdens
Pingback: Ich, der Autist – Philosophie des Gesundwerdens
Pingback: Dysautonomie – wenn das vegetative Nervensystem aus dem Gleichgewicht gerät – Philosophie des Gesundwerdens
Pingback: Die 5 Phasen der Heilung des Gehirns – Philosophie des Gesundwerdens
Pingback: Antientzündliche Zutat fürs Gehirn: Safran – Philosophie des Gesundwerdens
Pingback: Warum Meditation und Achtsamkeit bei dir nicht wirken oder sogar Probleme bereiten könnte – Philosophie des Gesundwerdens
Pingback: Tagebuch Azoren Teil II – Philosophie des Gesundwerdens
Pingback: Gastbeitrag: Definition, Ursachen und Heilung von Autoimmunkerkrankungen – Philosophie des Gesundwerdens
Pingback: Autismus Spektrum Störung, Asthma, Allergien und Umwelttoxine – Philosophie des Gesundwerdens
Pingback: Persönliche Freiheit, globale Geschehnisse, wer hat die Verantwortung, was ist die garantiert sicherste und gesündeste Wahl hier? – Philosophie des Gesundwerdens